Hjerteskader og mikrobølgestråling
Elektromagnetisme er involveret i både langsigtede og højeffektive applikationer inden for kommunikation, medicin, transport og militære områder, og mennesker indenfor disse områder bliver ubevidst udsat for strålingsmiljøet i lang tid, hvilket forårsager forskellig sundhedsrisici. Formålet med undersøgelsen var at simulere det arbejdsmiljø mennesker, i erhverv med særlig megen elektromagnetisk stråling, færdes i for at klarlægge den resulterende strålingsinducerede stressrespons og hjerteskader.
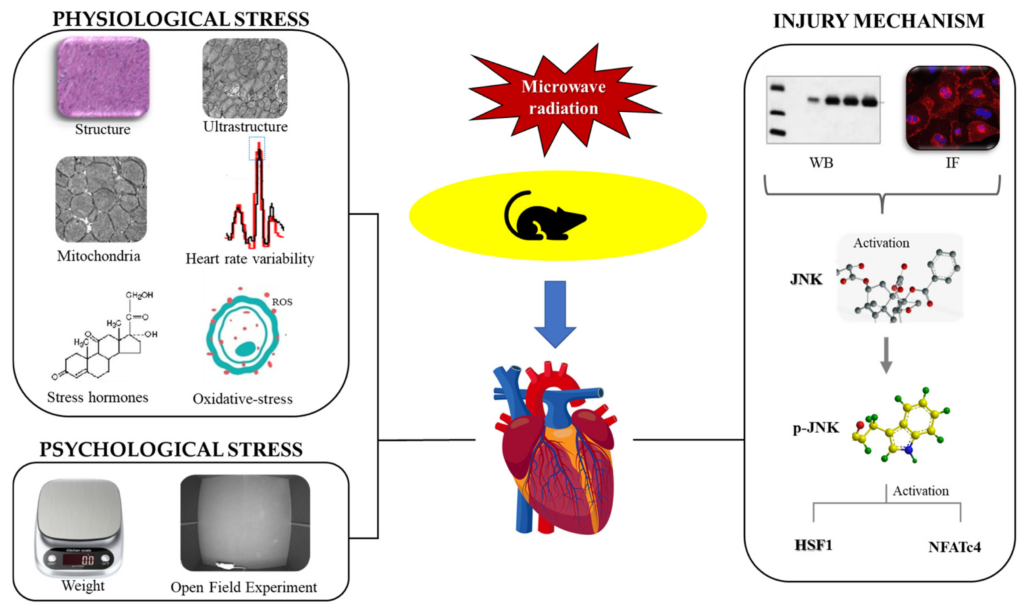
Undersøgelsen fandt, at stråling kan føre til desorganisering, fragmentering og opløsning af myokardiefibre, alvorlig mitokondriel kavitation, mitokondriel dysfunktion, oxidativ stressskade i myokardiet, stigning af stresshormon i serum, betydelige ændringer i HRV og en langsom stigning i vægt.
Årsagen til hjerteskade fra langvarig og højeffekt mikrobølgestråling kan være resultatet af en kombination af de termiske og ikke-termiske virkninger. Derfor bør udsættelsen for mikrobølger, specielt i nogle erhvervsgrupper, nedbringes så meget som muligt.
Forsknings rapporten ‘Fysiologisk og psykologisk stress af mikrobølgestråling-induceret hjerteskader hos rotter’ blev offentliggjort i International Journal of Molecular Sciences den 25. marts 2023.
Vi bringer her et uddrag af forskningsrapporten på dansk. Den fulde rapport er fri tilgængelig.
Foto: Robina Weermeijer, Unsplash.
Li D, Xu X, Yin Y, Yao B, Dong J, Zhao L, Wang H, Wang H, Zhang J, Peng R. Physiological and Psychological Stress of Microwave Radiation-Induced Cardiac Injury in Rats. Int J Mol Sci. 2023 Mar 25;24(7):6237. doi: 10.3390/ijms24076237.
Abstrakt
Elektromagnetiske bølger er meget udbredt på både militære og civile områder, hvilket kan forårsage langvarig og høj effekt eksponering for visse befolkninger og kan udgøre en sundhedsfare. Formålet med denne undersøgelse var at simulere det langvarige og højeffektive arbejdsmiljø for arbejdere i erhverv med særlig elektromagnetisk stråling for at klarlægge den strålingsinducerede stressrespons og hjerteskade og dermed få indsigt i mekanismerne for skader forårsaget af elektromagnetisk stråling. I denne undersøgelse var kombinationen af mikrobølger og stress et innovativt punkt, der sigtede mod at udvide forskningsretningen med hensyn til virkningen og mekanismen af hjerteskade forårsaget af stråling. Myokardiestrukturen blev observeret ved optisk og transmissionselektronmikroskop, mitokondriel funktion blev detekteret ved flowcytometri, oxidative-stress-markører blev detekteret af mikropladelæser, serumstresshormon blev detekteret ved radioimmunoassay, og hjertefrekvensvariabilitet (HRV) blev analyseret ved multikanal- fysiologisk optager. Rotterne blev vejet og udsat for et åbent feltforsøg. Western blot (WB) og immunfluorescens (IF) blev brugt til at påvise udtryk og fordelinger af JNK (c-Jun N-terminal kinase), p-JNK (phosphoryleret c-Jun N-terminal kinase), HSF1 (varmechokfaktor) og NFATc4 (nuklear faktor af aktiveret T-celle 4). Undersøgelsen fandt, at stråling kan føre til desorganisering, fragmentering og opløsning af myokardiefibre, alvorlig mitokondriel kavitation, mitokondriel dysfunktion, oxidativ stressskade i myokardiet, stigning til stresshormon i serum, betydelige ændringer i HRV og en langsom stigning i vægt. Det åbne felt-eksperiment indikerede, at rotterne oplevede angst og depression og havde nedsat træningskapacitet efter bestråling. Ekspressionerne af JNK, p-JNK, HSF1 og NFATc4 i myokardievæv blev alle øget. Ovenstående resultater antydede, at 30 mW/cm2 S-bånds mikrobølgestråling i 35 minutter kunne forårsage både fysiologiske og psykologiske stressskader hos rotter; skaden var relateret til aktiveringen af JNK-banen, som gav nye ideer til forskning i beskyttelse mod stråling.
1. Introduktion
Med videnskabens og teknologiens fremskridt har elektromagnetiske stråler af forskellige bølgelængder og frekvenser oversvømmet vores opholds- og arbejdsrum [1]. Elektromagnetisme er involveret i langsigtede og højeffektive applikationer inden for kommunikation, medicin, transport og militære områder, og mennesker bliver uden at vide det udsat for strålingsmiljøet i lang tid, hvilket forårsager sundhedsfarer. Formålet med denne undersøgelse er at simulere det langsigtede og højeffektive arbejdsmiljø for mennesker i erhverv med særlig elektromagnetisk stråling for at klarlægge den resulterende strålingsinducerede stressrespons og hjerteskade, og dermed udvide forskningsretningen vedrørende skademekanismen og give nye mål for forskningen af beskyttelse mod stråling. En række undersøgelser har vist, at overdreven elektromagnetisk stråling kan forårsage skader i flere organer i en organisme [2], medieret gennem både termiske og ikke-termiske effekter. På nuværende tidspunkt har forskningen i de ikke-termiske effekter været relativt omfattende, selvom forskningen i den termiske effekt stadig har været relativt sparsom. Skademekanismerne for de ikke-termiske effekter, såsom energimetabolismeforstyrrelser og oxidativ stressskade, er stort set blevet klarlagt [3], mens de termiske virkningsskademekanismer ikke er blevet systematisk undersøgt. Denne undersøgelse har til formål at udforske de skademekanismer, der er involveret i de termiske skadevirkninger af elektromagnetisk stråling.
Hjertet og stress
Som et af de mest følsomme målorganer for elektromagnetisk stråling [4] er hjertet organet for kredsløbets drivkraft med aktiv og fint koordineret elektrisk aktivitet. Det er ekstremt følsomt over for nervøs og endokrin regulering, hvilket fremgår af det faktum, at hjertets elektriske aktivitet er direkte korreleret til de sympatiske-binyre- og parasympatiske aktiviteter, og visse hormoner er vigtige udløsende faktorer for hjertesygdomme. Neuroendokrine lidelser kan føre til ikke kun hjerteskade, men også den fysiologiske stressreaktion, hvilket tyder på, at hjerteskade og stress kan være tæt forbundet. Forholdet mellem stress og hjertets strukturelle og funktionelle ændringer efter elektromagnetisk stråling er ikke blevet omhyggeligt undersøgt. Stressreaktionen er en uspecifik reaktion fra kroppen på en stimulus. Når den termiske effekt af elektromagnetisk stråling akkumuleres i et vist omfang, bliver kroppen termisk belastet. Varmestressresponsen er hovedsageligt forårsaget af varmeakkumulering og deraf følgende dehydrering og elektrolytforstyrrelser osv. Stressrespons induceret af elektromagnetisk stråling er ikke blevet systematisk undersøgt, andet end gennem oxidativ stress, dvs. ændringer i peroxider og antioxidantenzymer. Derfor sigtede denne undersøgelse på at studere skaden og mekanismen af de termiske effekter efter stråling ud fra et stressperspektiv. Dette kan være et gennembrud i retning af forskning vedrørende elektromagnetisk stråling-induceret hjerteskade.
Der er i øjeblikket mangel på undersøgelser vedrørende de biologiske virkninger af elektromagnetisk stråling på mekanismen for stressskader, og der er ingen relevant forskning i, hvordan man kan evaluere sværhedsgraden af stress-induceret hjerteskade. Derfor blev det foreslået, at vi bruger elektromagnetiske bølger til at udstråle rotter og til at klassificere indikatorer baseret på fysiologiske og psykologiske belastninger. Graden af fysiologisk stress-induceret skade blev evalueret af indikatorer, der vil afspejle hjertets strukturer og funktioner [5] samt kropsvægt. Et åbent felt-eksperiment blev brugt som guldstandarden til at evaluere, om den psykologiske stress-model blev etableret med succes [6,7,8], for at klarlægge den vellykkede konstruktion af stressmodellen på det fysiologiske og psykologiske niveau, og for at lægge grunden for forskningen i mekanismen for varmestress.
I mekanismeundersøgelser kan elektromagnetisk stråling øge ekspressionen af varmechokprotein 72 (Hsp72) signifikant i rotters myokardium. Hsp72 kan modstå varmestressskade og derved hæmme ekspressionen og aktiveringen af stressmarkørprotein JNK. Men når stressreaktionen når en vis grad af sværhedsgrad, vil den regulatoriske effekt af Hsp72 mislykkes, og JNK-vejen vil blive aktiveret. Det er blevet bredt rapporteret i litteraturen, at JNK-vejen kan aktivere ved termisk stimulering [9,10]. HSF1 nedstrøms for JNK har også en transaktiverende evne [11] og kan aktiveres under stress forårsaget af termisk stimulering; desuden er NFATc4 nedstrøms for JNK tæt relateret til Ca2+ transport [12] og kan regulere hjertets elektrofysiologiske funktion. Derfor blev JNK, p-JNK, HSF1 og NFATc4 udvalgt til denne undersøgelse for at undersøge mekanismen for stressskade, som kunne give indsigt i beskyttelsen af elektromagnetisk stråling.
3. Diskussion
Elektromagnetiske bølger er næsten allestedsnærværende i det moderne liv, hvoraf S-bånds stråling er det elektromagnetiske bølgebånd med en frekvens på 2-4 GHz og er meget udbredt i både civile og militære områder. Mange avancerede kommunikationsnetværk som 5G og trådløs routing bruger S-bånds mikrobølger, som udsætter mennesker for mikrobølgestråling i lang tid, uden at de ved det, hvilket forårsager sundhedsskade [2]. Hjertet er et organ, der er følsomt over for elektromagnetisk stråling [4] og reguleres af både neurologiske og endokrine systemer. Da neuroendokrin forstyrrelse danner det fysiologiske grundlag for stress, antog vi, at stress også kunne føre til hjerteskade. Der var dog ingen eksisterende relateret forskning om mikrobølgestråling-induceret hjerteskade og stress. Derfor tog denne undersøgelse kombinationen af mikrobølge og stress som et innovativt punkt for at udvide retningen for undersøgelsen af effekten og mekanismen af elektromagnetisk stråling-induceret hjerteskade.
Fysiologisk stress og psykisk stress
I denne undersøgelse blev stressskader opdelt i to kategorier: fysiologisk stress og psykisk stress. Indikatorerne for fysiologisk stress afspejlede hovedsageligt strukturelle og funktionelle skader på hjertet, mens indikatorerne for psykologisk stress afspejlede ændringer i humør og adfærd. Graden af fysiologisk stressskade blev først vurderet ved optisk og elektronmikroskop for at observere den strukturelle skade i myokardiet, og derefter blev mitokondriefunktionen og niveauerne af oxidativ stress, stress-relaterede hormoner og HRV (hjertefrekvensvariabilitet) detekteret for at evaluere hjertefunktionerne af energistofskifte, anti-stress-funktioner og elektrisk ledning. Endelig brugte denne undersøgelse kropsvægt og det åbne felt-eksperiment til at evaluere, om den psykologiske stress-model blev etableret med succes. Denne undersøgelse tog hjertet som gennembrudspunktet, estimerede omfattende skadeegenskaberne ved stressreaktion ud fra fysiologi og psykologi og undersøgte sammenhængen mellem hjerteskade og stressreaktion forårsaget af elektromagnetisk stråling.
Undersøgelser har vist, at hjertets sammentrækning og blodgennemstrømning kræver meget energi, så myokardievæv er rigt på myokardiefibre og mitokondrier. En strøm af undersøgelser har vist, at mikrobølgestråling kan forårsage myokardiestrukturelle skader, især mitokondrielle strukturelle skader [17,18]. Det er også blevet rapporteret, at mikrobølger kan føre til mitokondriel dysfunktion. Picard M et al. [19] fandt, at forekomsten af stress førte til skade på mitokondriel struktur, mPTP og MMP [20]. Myokardiestrukturen af denne model var signifikant beskadiget på dag 1 efter stråling, og skaden blev forværret på dag 7 efter eksponering. Det viste en restitutionstrend på dag 14 efter eksponering og blev grundlæggende genvundet på dag 28 efter eksponering. De vigtigste manifestationer var: myokardiefibre var uordnede i arrangement under optisk mikroskopi; myokardiefibre var knækket og opløst, Z-linjen var sløret; og mitokondrier led hævelse og blev kaviteret under elektronmikroskopi. Svarende til den mitokondrielle strukturelle skade, blev mitokondriel dysfunktion også fundet i denne undersøgelse, hvilket fremgår af den nedsatte permeabilitet af mPTP og unormal MMP, hvilket tyder på en energimetabolisme dysfunktion i hjertet, hvilket også var en af manifestationerne af fysiologiske stressskader i dette model.
ROS og oxidativ stress
Mitokondrier, som energifabrikker, er også de vigtigste produktionssteder for ROS, og akkumulering af ROS kan føre til oxidativ stressskade [21]. Som en slags fysiologisk stressrespons har oxidativ stress været den mest undersøgte mekanisme for elektromagnetisk skade. Kuchukashvili Z et al. [22] fandt, at under psykologiske stressforhold blev antioxidantsystemet forstyrret i kardiomyocytterne og blodet hos forsøgsrotter, hvilket manifesterede sig som en forbedring i processen af lipidperoxidation og et fald i aktiviteten af antioxidative enzymer. Denne undersøgelse fandt også, at indholdet af MDA steg og aktiviteten af SOD faldt efter stråling, mens skaden for det meste var kommet sig på dag 28 efter stråling; denne restitutionstid var grundlæggende den samme som for myokardiestrukturen. Vi foreslår, at eksistensen af oxidativ stressskade og svækkelsen af antistressfunktionen i myokardium foreløbigt bekræftede forekomsten af fysiologisk stressskade i denne model.
Neuroendokrine lidelser
Undersøgelser har vist, at stress kan forårsage neuroendokrine lidelser, såsom hyperaktivitet af HPA-aksen og autonom nervøs dysfunktion [23]. De fleste af de fysiologiske og biokemiske ændringer forårsaget af stressreaktionen er relateret til excitationen af HPA-aksen, den sympatiske-binyremarv og den parasympatiske nerve. Efter at HPA-aksen er aktiveret, kan den regulere sekretionen af ACTH fra hypofysen, sekretionen af COR fra binyremarven og sekretionen af CRH fra den paraventrikulære kerne. CRHs hovedfunktion er at stimulere udskillelsen af ACTH fra hypofysen efter at være blevet accepteret af CRH-receptoren i hypofysen, og ACTH fremmer udskillelsen af GC fra binyrebarken [24]. GC kan regulere stofskiftet af stoffer og vand-salt og ændre funktionen af blodet og kredsløbet, og derved forbedre kroppens tolerance og overlevelsesevne, når man står over for stressende stimuli [25]. Eksperimenterne af Blanchard R J og Zipes D P viste, at stress udløste en kompenserende fysiologisk reaktion i kroppen med forhøjede niveauer af stresshormoner såsom ACTH, CRH, E, GC, DA og andre stresshormoner [26,27]. I undersøgelser relateret til mikrobølgestråling har nogle forskere fundet ud af, at mikrobølger kan forårsage ændringer i hormonniveauer i serum, med forhøjet acetylcholin (Ach) og epinephrin (E), såvel som unormal hjerte-elektrofysiologisk funktion. Ifølge litteraturen og modelkarakteristika blev i alt seks stresshormoner påvist i dette eksperiment, blandt hvilke COR, CRH, ACTH og GC var de repræsentative hormoner for HPA-aksen. Resultaterne viste, at forhøjelse forekom på dag 1 efter eksponering og ikke kom sig på dag 28, hvilket tydede på stærk excitation og en langsom genopretning af HPA-aksen, hvor ændringerne i COR og CRH var mere udtalte. NE og DA, som er katekolaminer, var signifikant forøget på dag 1, 7, 14 og 28 efter eksponering, hvilket afspejler den stærke excitation af det sympatiske-binyremarvsystem, som blev antaget at være en af årsagerne til myokardiestrukturelle skader og ændringer i HRV i denne undersøgelse. Stigningen i hormonniveauer i denne undersøgelse indikerede, at hjertefunktionen var beskadiget, hvilket var et vigtigt grundlag for tilstedeværelsen af fysiologisk stressskade i denne model.
Hjertefrekvensen
Hjertefrekvens og myokardiets excitabilitet samt kontraktilitet afhænger af myokardiets iboende egenskaber, som moduleres af sympatiske og parasympatiske nerver i den intracardiale nodal plexus. Under en stressreaktion fører en passende stigning i hjertesympatiske tonus til en stigning i hjertefrekvens og myokardiekontraktilitet, mens parasympatisk nerve undertrykker overdreven sympatisk excitation. Når stressstimuleringen er for intens eller lang, kan den medføre overdreven aktivering af den sympatiske nerve og HPA-akser, og udskillelsen af relaterede hormoner vil også være overdreven. For høje katekolaminhormoner og COR kan forårsage en væsentlig stigning i kardiomyocytautoregulering, en stigning i vand- og natriumretention, myokardie K+ reduktion, lavere ventrikulær fibrilleringstærskel og en stigning i sandsynligheden for arytmi. Et stort antal undersøgelser har vist, at stress genereret af en vis stimuleringsintensitet kan føre til ændringer i forskellige elektrofysiologiske hjerteindikatorer [28]. Desuden er HRV (hjertefrekvensvariabilitet) væsentligt ændret hos stressede patienter, hvorved risikoen for hjertekarsygdomme øges [29,30]. Andre undersøgelser har indikeret, at HRV kan bruges til at vurdere niveauet af stress [31]. I alt ti HRV-relaterede indikatorer – fem tidsdomæne- og fem frekvensdomæne-relaterede indikatorer – blev analyseret i denne undersøgelse. Blandt dem var hjertefrekvensen signifikant øget, og gennemsnitlig RR, HRV tri-indeks, RMSSD og SDNN var signifikant faldet efter stråling, hvilket tyder på, at aktiviteten af ANS var ude af balance, hvilket resulterede i sympatisk nerveoverexcitation og nedsat parasympatisk nervefunktion. Derudover blev fem frekvensdomænerelaterede indikatorer også evalueret: LF, normaliseret LF og LF/HF-forhold var signifikant øget, hvilket indikerer øget aktivitet af den sympatiske nerve. Derudover var HF og regulariseret HF signifikant reduceret, hvilket tyder på nedsat parasympatisk aktivitet. I mellemtiden er det blevet rapporteret, at vagal depression var forbundet med et betydeligt tab af kropsvæsker under varmestress [32]. Derfor spekulerede vi i, at ændringerne i HRV noteret i denne undersøgelse kan være relateret til væsketab på grund af den termiske effekt af stråling. Ændringen i HRV forekom på dag 1 efter eksponering, og alle de tidsdomænerelaterede indekser blev gendannet på dag 28 efter stråling, hvorimod de tre indekser for LF i frekvensdomæneanalysen ikke var fuldt ud restitueret på dag 28, hvilket antydede at skaden forårsaget af elektromagnetisk stråling har en længerevarende effekt på EKG-signalet i lavfrekvensområdet. Resultaterne af tidsdomæne- og frekvensdomæneanalyse bekræftede excitationen af den sympatiske nerve og hæmningen af vagusnerven, hvilket tyder på svækkelsen af hjertets elektriske ledningsfunktion, hvilket endnu en gang demonstrerede tilstedeværelsen af fysiologisk stressskade i denne model.
Ovenstående forsøgsresultater gjorde det klart, at fysiologisk stressskade fandt sted i denne model, hvilket blev manifesteret i: den overdrevne aktivering af neuro-endokrine, hvilket førte til patologisk strukturel skade i myokardiet; unormal elektrofysiologisk funktion; og en stigning i niveauet af stresshormoner. På organelniveau udviste mitokondrier strukturel skade og dysfunktion, hvilket førte til en ubalance mellem de oxidative og antioxidante systemer i myokardievæv, hvilket resulterede i oxidativ stressskade. Selvom mitokondriefunktion, oxidativt stressniveau, stressrelaterede hormoner og HRV er indikatorer for fysiologisk stress, kunne disse også indikere eksistensen af psykologisk stressskade til en vis grad, selvom de ikke var guldstandarden for at verificere succesen af den psykologiske stress model. Derfor havde denne undersøgelse til formål yderligere at verificere, om den psykologiske stressmodel blev etableret med succes gennem vurdering af kropsvægt og udførelse af åbne felteksperimenter [33]. Vægten af rotter i gruppe R var bemærkelsesværdigt lavere end vægten af gruppe C mellem dag 1 og dag 7 efter stråling. I mellemtiden viste resultaterne af frimarksforsøget, at stråling kan forårsage angst og depression hos rotter. Ovenstående resultater antydede, at stråling kan forårsage følelsesmæssige abnormiteter hos rotter, og at den psykologiske stressmodel forårsaget af stråling blev etableret med succes.
Efter den vellykkede etablering af stressmodellen havde denne undersøgelse til formål at påvise ændringerne i vigtige molekyler i JNK-relaterede stressveje i post-stråling hjerteskade og i at udforske den mulige mekanisme for skade. Nogle undersøgelser har fundet, at ekspressionen af JNK i hjertevæv under varmestress blev signifikant øget og aktiveret af fosforylering, hvorved proteinernes ekspression af dets nedstrøms molekyler reguleres [34]. NFATc4-molekylet nedstrøms for JNK er relateret til Ca2+-udveksling af kardiomyocytter og er rigeligt udtrykt i myokardiet, hvilket har en vis regulerende effekt på hjertets elektriske ledningsfunktion [35].
HSF1 fremmer ekspressionen af Hsp72 under varmestimulering, hvilket kunne indikere forekomsten af varmestress til en vis grad [36]. Denne forskning var designet til at udforske ændringerne af JNK pathway-relateret proteinekspression af WB, for at verificere ekspressionsændringerne igen gennem IF og for at analysere fordelingsegenskaberne for proteinerne.
Resultaterne af WB og IF viste, at ekspressionen af stressproteiner var forhøjet, og phosphoryleringen af JNK blev øget. Ovenstående resultater gjorde det klart, at stressmodellen blev opbygget med succes på molekylært niveau; stigningen i HSF1 tydeliggjorde, at modellen var en varmestressmodel, hvilket tyder på, at den var relateret til den termiske effekt af elektromagnetisk stråling; stigningen i NFATc4 indikerede, at ændringen i HRV kan være relateret til Ca2+ transportforstyrrelse, hvilket gav en ny idé til fremtidig reguleringsforskning relateret til skademekanisme.
Opsummering
For at opsummere bruges elektromagnetisme til langsigtede og højeffektanvendelser inden for kommunikation, medicinske og militære områder, og modelleringsbetingelserne designet i dette eksperiment blev designet til at simulere det langsigtede arbejdsmiljø for specielle elektromagnetiske erhvervsgrupper, der forventer at give nye ideer til forskning i beskyttelse. Efter 35 minutters eksponering viste rotter en stigning i serumhormon, myokardiestrukturel skade, unormal HRV (hjertefrekvensvariabilitet), myokardie mitokondriel dysfunktion og oxidativ stressskade. Ovenstående resultater viste, at fysiologisk stressskade fandt sted i denne model; den psykologiske stress i dette modeldyr blev bekræftet af resultaterne af vægt og åbent felteksperiment samtidigt; og mekanismen for hjerteskade forårsaget af elektromagnetisk stråling kan være tæt forbundet med aktiveringen af JNK-vejen. Vi har plottet resultaterne af denne undersøgelse i figur 18. (se øverst)
Undersøgelsen undersøgte derfor, ud fra stress-perspektivet, forholdet mellem stress og ændringer i hjertets struktur og funktion efter elektromagnetisk stråling, og udforskede derefter dens mulige skadesmekanisme, hvilket udvidede en ny orientering for studiet af virkninger i feltet, og bidrog til at skabe et nyt mål for beskyttelse mod stråling. Vores undersøgelse foreslog, at årsagen til hjerteskade fra langvarig og højeffekt mikrobølgestråling kan være resultatet af en kombination af de termiske og ikke-termiske virkninger; derfor bør muligheden for hjerteskade fra mikrobølger minimeres i visse særlige erhvervsgrupper involveret i ovennævnte miljø ved at forkorte længden af en enkelt eksponering eller forlænge intervallet mellem eksponeringer så meget som muligt. I undersøgelsen af funktionelle indikatorer for tidlig varsling bør hjertefrekvensvariabilitet desuden bruges som et gennembrud med klinisk grænseflade til dybdegående validering for at fremme anvendelsen.
For en grundig gennemgang af resultater og metoder henvises til forskningsdokumentet:
https://www.mdpi.com/1422-0067/24/7/6237#B34-ijms-24-06237
Referencer:
- Sagar, S.; Adem, S.M.; Struchen, B.; Loughran, S.P.; Brunjes, M.E.; Arangua, L.; Dalvie, M.A.; Croft, R.J.; Jerrett, M.; Moskowitz, J.M.; et al. Comparison of radiofrequency electromagnetic field exposure levels in different everyday microenvironments in an international context. Environ. Int. 2018, 114, 297–306. [Google Scholar] [CrossRef] [PubMed]
- Stein, Y.; Udasin, I.G. Electromagnetic hypersensitivity (EHS, microwave syndrome)—Review of mechanisms. Environ. Res. 2020, 186, 109445. [Google Scholar] [CrossRef] [PubMed]
- Leach, V.; Weller, S.; Redmayne, M. A novel database of bio-effects from non-ionizing radiation. Rev. Environ. Health 2018, 33, 273–280. [Google Scholar] [CrossRef] [PubMed]
- Tang, J.; Zhang, Y.; Yang, L.; Chen, Q.; Tan, L.; Zuo, S.; Feng, H.; Chen, Z.; Zhu, G. Exposure to 900 MHz electromagnetic fields activates the mkp-1/ERK pathway and causes blood-brain barrier damage and cognitive impairment in rats. Brain Res. 2015, 1601, 92–101. [Google Scholar] [CrossRef] [PubMed]
- Ruiz, P.; Gabarre, P.; Chenevier-Gobeaux, C.; François, H.; Kerneis, M.; Cidlowski, J.A.; Oakley, R.H.; Lefèvre, G.; Boissan, M. Case report: Changes in the levels of stress hormones during Takotsubo syndrome. Front. Cardiovasc. Med. 2022, 9, 931054. [Google Scholar] [CrossRef]
- Guo, S.; Dong, Y.; Cheng, X.; Chen, Z.; Ni, Y.; Zhao, R.; Ma, W. Chronic Psychological Stress Disrupts Iron Metabolism and Enhances Hepatic Mitochondrial Function in Mice. Biol. Trace Element Res. 2022, 201, 1761–1771. [Google Scholar] [CrossRef]
- Zhao, X.; Cao, F.; Liu, Q.; Li, X.; Xu, G.; Liu, G.; Zhang, Y.; Yang, X.; Yi, S.; Xu, F.; et al. Behavioral, inflammatory and neurochemical disturbances in LPS and UCMS-induced mouse models of depression. Behav. Brain Res. 2019, 364, 494–502. [Google Scholar] [CrossRef]
- Li, Q.; Qi, F.; Meng, X.; Zhu, C.; Gao, Y. Mst1 regulates colorectal cancer stress response via inhibiting Bnip3-related mitophagy by activation of JNK/p53 pathway. Cell Biol. Toxicol. 2017, 34, 263–277. [Google Scholar] [CrossRef]
- Pantos, C.; Malliopoulou, V.; Mourouzis, I.; Moraitis, P.; Tzeis, S.; Thempeyioti, A.; Paizis, I.; Cokkinos, A.; Carageorgiou, H.; Varonos, D.D.; et al. Involvement of p38 MAPK and JNK in heat stress-induced cardioprotection. Basic Res. Cardiol. 2003, 98, 158–164. [Google Scholar] [CrossRef]
- Chen, X.-J.; Tang, Z.-Z.; Zhu, G.-G.; Cheng, Q.; Zhang, W.-K.; Li, H.-M.; Fu, W.; Lu, Q.-P. JNK signaling is required for the MIP-1α-associated regulation of Kupffer cells in the heat stroke response. Mol. Med. Rep. 2017, 16, 2389–2396. [Google Scholar] [CrossRef][Green Version]
- Wang, J.; Xin, L.H.; Cheng, W.; Wang, Z.; Zhang, W. Effect of heat shock factor 1 on airway hyperresponsiveness and airway inflammation in mice with allergic asthma. Zhongguo Dang Dai Er Ke Za Zhi 2017, 19, 222–228. [Google Scholar] [PubMed]
- Yang, T.T.C.; Xiong, Q.; Enslen, H.; Davis, R.J.; Chow, C.-W. Phosphorylation of NFATc4 by p38 Mitogen-Activated Protein Kinases. Mol. Cell. Biol. 2002, 22, 3892–3904. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Bangsumruaj, J.; Kijtawornrat, A.; Kalandakanond-Thongsong, S. Effects of chronic mild stress on GABAergic system in the paraventricular nucleus of hypothalamus associated with cardiac autonomic activity. Behav. Brain Res. 2022, 432, 113985. [Google Scholar] [CrossRef] [PubMed]
- Nagel, C.; Trenk, L.; Aurich, C.; Ille, N.; Pichler, M.; Drillich, M.; Pohl, W.; Aurich, J. Sympathoadrenal balance and physiological stress response in cattle at spontaneous and PGF 2α -induced calving. Theriogenology 2016, 85, 979–985. [Google Scholar] [CrossRef] [PubMed]
- Li, D.; Xu, X.; Gao, Y.; Wang, J.; Yin, Y.; Yao, B.; Zhao, L.; Wang, H.; Wang, H.; Dong, J.; et al. Hsp72-Based Effect and Mechanism of Microwave Radiation-Induced Cardiac Injury in Rats. Oxidative Med. Cell. Longev. 2022, 2022, 1–15. [Google Scholar] [CrossRef] [PubMed]
- Asadi, F.; Razmi, A.; Dehpour, A.R.; Shafiei, M. Tropisetron inhibits high glucose-induced calcineurin/NFAT hypertrophic pathway in H9c2 myocardial cells. J. Pharm. Pharmacol. 2016, 68, 485–493. [Google Scholar] [CrossRef]
- Yin, Y.; Xu, X.; Gao, Y.; Wang, J.; Yao, B.; Zhao, L.; Wang, H.; Wang, H.; Dong, J.; Zhang, J.; et al. Abnormal Expression of Connexin43 in Cardiac Injury Induced by S-Band and X-Band Microwave Exposure in Rats. J. Immunol. Res. 2021, 2021, 7145415. [Google Scholar] [CrossRef]
- Zhang, J.; Peng, R.-Y.; Ren, J.-H.; Li, J.; Wang, S.-M.; Gao, Y.-B.; Dong, Q.; Zhao, L.; Liu, S.-C. [The protective effects of Aduola Fuzhenglin on the heart injury induced by microwave exposure in rats]. Zhonghua lao dong wei sheng zhi ye bing za zhi = Zhonghua laodong weisheng zhiyebing zazhi = Chin. J. Ind. Hyg. Occup. Dis. 2011, 29, 367–370. [Google Scholar]
- Picard, M.; McEwen, B.S. Psychological Stress and Mitochondria: A Conceptual Framework. Psychosom. Med. 2018, 80, 126–140. [Google Scholar] [CrossRef]
- Li, Y.; Ma, Y.; Dang, Q.-Y.; Fan, X.-R.; Han, C.-T.; Xu, S.-Z.; Li, P.-Y. Assessment of mitochondrial dysfunction and implications in cardiovascular disorders. Life Sci. 2022, 306, 120834. [Google Scholar] [CrossRef]
- Muscari, C.; Giaccari, A.; Giordano, E.; Clô, C.; Guarnieri, C.; Caldarera, C.M. Role of reactive oxygen species in cardiovascular aging. Mol. Cell. Biochem. 1996, 160–161, 159–166. [Google Scholar] [CrossRef]
- Kuchukashvili, Z.; Menabde, K.; Chachua, M.; Burjanadze, G.; Chipashvili, M.; Koshoridze, N. Functional state of rat cardiomyocytes and blood antioxidant system under psycho-emotional stress. Acta Biochim. Biophys. Sin. 2011, 43, 480–486. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Smith, T.W.; Birmingham, W.; Uchino, B.N. Evaluative threat and ambulatory blood pressure: Cardiovascular effects of social stress in daily experience. Health Psychol. 2012, 31, 763–766. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Gerber, M.; Brand, S.; Lindwall, M.; Elliot, C.; Kalak, N.; Herrmann, C.; Pühse, U.; Jonsdottir, I.H. Concerns regarding hair cortisol as a biomarker of chronic stress in exercise and sport science. J. Sports Sci. Med. 2012, 11, 571–581. [Google Scholar]
- Hatalski, C.; Brunson, K.; Tantayanubutr, B.; Chen, Y.; Baram, T. Neuronal activity and stress differentially regulate hippocampal and hypothalamic corticotropin-releasing hormone expression in the immature rat. Neuroscience 2000, 101, 571–580. [Google Scholar] [CrossRef][Green Version]
- Retana-Márquez, S.; Bonilla-Jaime, H.; Vázquez-Palacios, G.; Domínguez-Salazar, E.; Martínez-García, R.; Velázquez-Moctezuma, J. Body weight gain and diurnal differences of corticosterone changes in response to acute and chronic stress in rats. Psychoneuroendocrinology 2002, 28, 207–227. [Google Scholar] [CrossRef] [PubMed]
- Blanchard, R.J.; Blanchard, D.C. Antipredator defensive behaviors in a visible burrow system. J. Comp. Psychol. 1989, 103, 70–82. [Google Scholar] [CrossRef] [PubMed]
- Zipes, D.P.; Rubart, M. Neural modulation of cardiac arrhythmias and sudden cardiac death. Hear. Rhythm. 2006, 3, 108–113. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Murdock, K.W.; LeRoy, A.S.; Fagundes, C.P. Trait hostility and cortisol sensitivity following a stressor: The moderating role of stress-induced heart rate variability. Psychoneuroendocrinology 2017, 75, 222–227. [Google Scholar] [CrossRef][Green Version]
- Petrowski, K.; Wichmann, S.; Siepmann, T.; Wintermann, G.-B.; Bornstein, S.R.; Siepmann, M. Effects of Mental Stress Induction on Heart Rate Variability in Patients with Panic Disorder. Appl. Psychophysiol. Biofeedback 2017, 42, 85–94. [Google Scholar] [CrossRef]
- Lee, M.-S.; Lee, J.; Park, B.-J.; Miyazaki, Y. Interaction with indoor plants may reduce psychological and physiological stress by suppressing autonomic nervous system activity in young adults: A randomized crossover study. J. Physiol. Anthr. 2015, 34, 21. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Macartney, M.J.; Meade, R.D.; Notley, S.R.; Herry, C.L.; Seely, A.J.E.; Kenny, G.P. Fluid Loss during Exercise-Heat Stress Reduces Cardiac Vagal Autonomic Modulation. Med. Sci. Sports Exerc. 2020, 52, 362–369. [Google Scholar] [CrossRef] [PubMed]
- Chiba, S.; Numakawa, T.; Ninomiya, M.; Richards, M.C.; Wakabayashi, C.; Kunugi, H. Chronic restraint stress causes anxiety- and depression-like behaviors, downregulates glucocorticoid receptor expression, and attenuates glutamate release induced by brain-derived neurotrophic factor in the prefrontal cortex. Prog. Neuro-Psychopharmacol. Biol. Psychiatry 2012, 39, 112–119. [Google Scholar] [CrossRef]
- Liu, Z.; Ji, J.; Zheng, D.; Su, L.; Peng, T. Calpain-2 protects against heat stress-induced cardiomyocyte apoptosis and heart dysfunction by blocking p38 mitogen-activated protein kinase activation. J. Cell. Physiol. 2019, 234, 10761–10770. [Google Scholar] [CrossRef] [PubMed]
- Herum, K.M.; Lunde, I.G.; Skrbic, B.; Florholmen, G.; Behmen, D.; Sjaastad, I.; Carlson, C.R.; Gomez, M.F.; Christensen, G. Syndecan-4 signaling via NFAT regulates extracellular matrix production and cardiac myofibroblast differentiation in response to mechanical stress. J. Mol. Cell. Cardiol. 2013, 54, 73–81. [Google Scholar] [CrossRef][Green Version]
- Peng-Winkler, Y.; Büttgenbach, A.; Rink, L.; Wessels, I. Zinc supplementation prior to heat shock enhances HSP70 synthesis through HSF1 phosphorylation at serine 326 in human peripheral mononuclear cells. Food Funct. 2022, 13, 9143–9152. [Google Scholar] [CrossRef]




Pingback: Hvordan skader elektrosmog? - nejtil5g.dk