Mobiltelefoner: Stigende antal hjernetumorer i USA
Illustration: Mohamed Hassan, Pixabay
Siden år 2000 har USA oplevet betydelige stigninger i de aldersjusterede forekomster af fire hoved- og halstumorer forbundet med mobiltelefonbrug, herunder den mest alvorlige maligne hjernetumor (glioblastom), en ikke-malign tumor på ydersiden af hjernen (meningiom) og kræft i spyt- og skjoldbruskkirtlerne.
Blandt de unge under 20 år steg ikke-malignt meningeom og kræft i skjoldbruskkirtlen signifikant.
Befolkningen i USA steg 16 % mellem 2000 og 2019, hvorimod antal tilfælde for disse fire tumorer ifølge National Cancer Institutes SEER 22-register havde en endnu større stigning: 53 % for glioblastom, 124 % for ikke -malignt meningeom, 52% for spytkirtelkræft og 132% for skjoldbruskkirtelkræft.
Stigningen i de aldersjusterede incidens rater for disse fire tumorer kan sandsynligvis tilskrives de kroniske virkninger af brugen mobiltelefoner i tillæg til andre faktorer, herunder bedre screening.
Dataene for tumor incidens raterne er samlet fra SEER 22 Registry af Joel M. Moskowitz, Ph.D. Direktør for Family and Community Health, University of California. Originalartiklen finder du HER, her har Moskowitz medtaget flere forskningsartikler. SEER 22 Registry dækker 48% af den samlede amerikanske befolkning. Dataene er alderstilpasset til befolkningen i år 2000, dermed er de observerede forskelle over tid ikke påvirket af ændringer i befolkningens alderssammensætning.
Indhold:
- Forekomsten af de fire hoved- og halstumorer i USA forbundet med mobiltelefonbrug
- American Brain Tumor Association
- Begrænsningerne i kræftregistre
Forekomsten af de fire hoved- og halstumorer
Glioblastom
Glioblastom er den mest almindelige maligne tumor i hjerne- og centralnervesystemet (dvs. cancer) med en median overlevelsesrate på blot 8 måneder.
Selvom den aldersjusterede forekomst af alle kræftformer i hjernen og nervesystemet i USA faldt signifikant med 0,4 % om året fra 2009 til 2019, steg forekomsten af glioblastom markant med 1,2 % om året fra 2000 til 2004.
Fra 2000 til 2019 steg forekomsten af glioblastom betydeligt i tre aldersgrupper – med 2,3 % om året for børn under 15 år, med 1,3 % om året for unge voksne i alderen 15 til 39 år og med 0,3 % om året for voksne i alderen 65 til 74 år. Blandt voksne fra 75 år og ældre steg glioblastom signifikant med 1,3 % om året fra 2000-2009.
Statistikken finder du HER.
Ikke-malignt meningiom
I USA er ikke-malignt meningeom den mest almindelige hjernetumor. Forekomsten af denne tumor blev ikke rapporteret til SEER-registret før 2004.
Den samlede aldersjusterede forekomst af ikke-malignt meningeom i hjernen og nervesystemet steg signifikant med 70 % i USA fra 2004 (6,46 pr. 100.000) til 2019 (11,01 pr. 100.000). Fra 2004 til 2008 var stigningen på 12,3 % om året, og fra 2008 til 2019 var stigningen 2,1 % om året.
Blandt unge under 20 år steg forekomsten af ikke-malignt meningeom signifikant med 2,8 % om året fra 2004 til 2019.
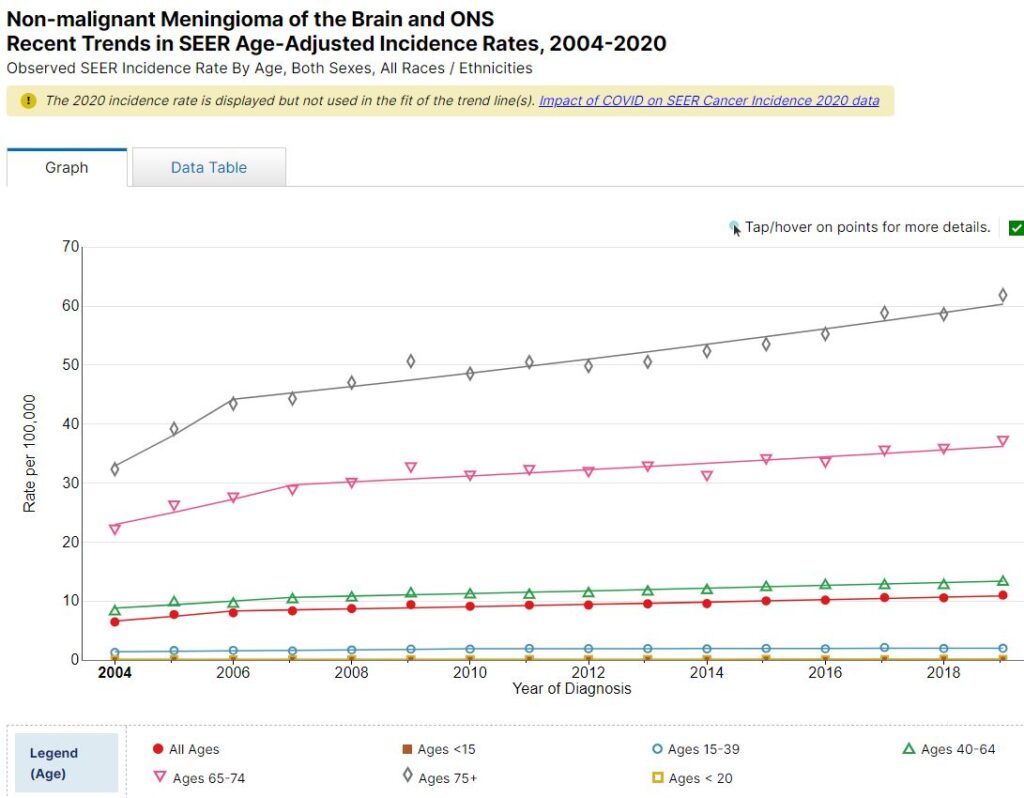
Statistikken finder du HER.
Kræft i skjoldbruskkirtlen
Den aldersjusterede forekomst af kræft i skjoldbruskkirtlen steg generelt i USA fra 2000 til 2009 med 7,1 % om året og fra 2009 til 2014 med 2,3 % om året. Blandt unge under 20 år steg forekomsten af skjoldbruskkirtelkræft markant med 4,5 % om året fra 2000 til 2019.
Statistikken finder du HER.
Spytkirtelkræft
Den aldersjusterede forekomst af spytkirtelcancer steg generelt i USA med 0,6 % om året fra 2000 til 2019.
Statistikken finder du HER.
Reference:
SEER*Explorer: An interactive website for SEER cancer statistics [Internet]. Surveillance Research Program, National Cancer Institute; 2023 Apr 19. [updated: 2023 Nov 16; cited 2024 Jan 9]. Available from:
https://seer.cancer.gov/statistics-network/explorer/.
Data source(s): SEER Incidence Data, November 2022 Submission (1975-2020), SEER 22 registries.
American Brain Tumor Association
American Brain Tumor Association blev grundlagt i 1973 af Susan Netchin Kramer og Linda Gene Goldstein, som begge havde unge døtre med hjernetumorer.
Hjernen og rygmarven danner sammen centralnervesystemet (CNS). Hjernen er et komplekst organ, der består af nerver og bindevæv. Nerver i hjernen og rygmarven sender beskeder gennem hele kroppen. CNS styrer og regulerer alle kroppens funktioner.
Nedenstående oversigt fra American Brain Tumor Association finder du HER.
Hjernetumor statistik – USA
Hjernetumorer rapporteres hos mennesker i alle aldre, racer, etniciteter og køn. Over 1.3 millioner amerikanere lever med en primær eller sekundær / metastatisk hjernetumor i dag. 3 Primære tumorer stammer fra hjernen, og de mest almindelige typer er meningiomer, hypofysetumorer og gliomer. Metastatiske eller sekundære hjernetumorer opstår uden for hjernen i et andet organ, såsom bryst eller lunge og spredes til hjernen. De er de mest almindelige hjernetumorer. 4
Medmindre andet er angivet, kommer følgende statistikker fra Central Brain Tumor Registry of the United States Annual Report 4:
- Omkring 90.000 mennesker diagnosticeres med en primær hjernetumor hvert år.
- Hjerne og andre CNS tumorer er den femte mest almindelige kræftform.
- Over 1 million mennesker lever med en diagnose af en primær hjernetumor.
- Der er mere end 100 forskellige typer af primære hjerne og CNS tumorer.
- Næsten en tredjedel (27,9 procent) af hjerne- og centralnervesystemets (CNS) tumorer er ondartede.
- Hjerne- og CNS-tumorer er de mest almindelige kræftformer diagnosticeret hos børn i alderen 0-14 år.
- Mere end 28.000 børn i USA er i øjeblikket diagnosticeret med en hjernetumor.
- Omkring 3.400 børn (i alderen 0-14) diagnosticeres med en primær hjernetumor hvert år.
- Omkring 12.800 unge og unge voksne (i alderen 15-39) diagnosticeres med en primær hjernetumor hvert år.
- Incidensraten for hjerne- og CNS-tumorer er højest blandt dem i alderen 85 år og ældre.
- Hvert år dør ca. 17.200 mennesker af en ondartet hjernetumor. Overlevelse efter diagnose med en primær hjernetumor varierer betydeligt efter alder, race, geografisk placering, tumortype, tumorplacering og molekylære markører.
Risikofaktorer for hjernetumorer
Genetiske og arvelige risikofaktorer
Arvelige træk bæres i gener. Hvert individ har to kopier af hvert gen, en fra hver forælder. Gener indeholder ofte små ændringer. Nogle gange forårsager disse ændringer ingen problemer, men nogle gange er disse ændringer mere alvorlige og kan forstyrre den måde, genet skal fungere på.
Der er et par sjældne, arvelige genetiske syndromer, der er forbundet med hjernetumorer, herunder Neurofibromatosis 1 (NF1 gen), Neurofibromatosis 2 (NF2 gen), Turcot syndrom (APC gen), Gorlin syndrom (PTCH gen), Tuberous Sclerosis (TSC1 og TSC2 gener) og Li-Fraumeni syndrom (TP53 gen).
Selvom 5-10% af personer med hjernetumorer har en familie historie med en hjernetumor, synes langt de fleste CNS-tumorer ikke at være en del af arvelige genetiske syndromer.6 En række undersøgelser har identificeret genetiske varianter, der kan være forbundet med en øget risiko for visse hjernetumorer, herunder gliom7 og meningiom.8 En sådan undersøgelse er Gliogene, en undersøgelse, der blev startet i 2004 for at finde et familiært link i hjernekræft.10 Undersøgelsesresultater fra 2017 viser, at mens der er nogle arvelige ligheder i gliomtumorer mellem familiemedlemmer, er der ikke en statistisk signifikant forskel mellem familier, der har tumorer med lignende arvelige træk sammenlignet med familier med tumorer, der har forskellige arvelige træk. Også i familier med mere end et gliom har tumorerne tendens til at have de samme molekylære markører. Denne undersøgelse fortsætter med at indsamle og analysere data. Deltagerne kan være berettiget til at deltage i Gliogene-undersøgelsen, hvis et berørt eller upåvirket familiemedlem har to eller flere rapporterede gliomer. Du kan finde mere om denne undersøgelse her.
Miljømæssige risikofaktorer
Bortset fra familiehistorie er den mest konsekvent identificerede risikofaktor forbundet med hjernetumorudvikling terapeutisk eller højdosis ioniserende stråling.11 Med hensyn til medicinsk diagnostisk strålingseksponering er der rapporteret små stigninger i hjernetumorrisici.11,12 Selvom visse hjernescanninger og strålebehandling, der anvendes til behandling af hjernetumorer, bruger ioniserende stråling, er risikoen for at udvikle en ny hjernetumor på grund af disse årsager meget lav. Erhvervseksponering blandt medicinske strålingsarbejdere har været forbundet med ca. dobbelt så stor risiko for hjernekræftdødelighed, selv om der ikke forelå data om strålingseksponeringsniveauet.13
Med hensyn til virkningen af ikke-ioniserende stråling fra mobiltelefoner har sammenhængen mellem denne eksponering og hjernekræft været genstand for megen forskning. Radiofrekvente felter blev klassificeret af Verdenssundhedsorganisationens Internationale Agentur for Kræftforskning (IARC) i 2011 som et muligt kræftfremkaldende stof efter observation af øget gliomrisiko blandt tunge mobiltelefonbrugere:14
Industrielle kemikalier har længe været mistænkt som en årsag til gliom på grund af deres evne til at krydse blod-hjerne-barrieren.15 Blod-hjerne-barrieren beskytter hjernen mod toksiner og patogener. På trods af at mange kemiske, miljømæssige og erhvervsmæssige eksponeringer er blevet undersøgt i epidemiologiske undersøgelser af gliom, har resultaterne været inkonsekvente for de fleste faktorer. Selvom det ikke er præcist defineret, rapporteres der ofte en sammenhæng mellem eksogene hormoner (f.eks. Orale præventionsmidler, hormonerstatningsterapier) og meningiomrisiko, og patienter kan derfor diskutere dette emne med deres sundhedsudbydere.16
For at fortsætte undersøgelserne af årsagen til hjernetumorer blev Brain Tumor Epidemiology Consortium (BTEC) udviklet til at bringe forskere sammen for at identificere risikofaktorer, resultater og forebyggelse af hjernetumorer. Det er en non-profit organisation, der letter samarbejdet mellem forskning for at uddanne offentligheden om nye resultater.
Referencer
- Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 2016;131(6):803-820.
- Louis DN, Perry A, Wesseling P, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021.
- Porter KR, McCarthy BJ, Freels S,Kim Y, Davis FG. Prevalence estimates for primary brain tumors in the United States by age, gender, behavior, and histology. Neuro-Oncology 12(6):520-527, 2010.
- Ostrom QT, Patil N, Cioffi G, Waite K, Kruchko C, Barnholtz-Sloan JS. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2013–2017. Neuro Oncol. 2020.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020 Jan;70(1):7-30. doi: 10.3322/caac.21590. Epub 2020 Jan 8. PubMed PMID: 31912902.
- Wrensch M, Lee M, Miike R, et al. Familial and personal medical history of cancer and nervous system conditions among adults with glioma and controls. Am J Epidemiol. 1997;145(7):581-593.
- Melin BS, Barnholtz-Sloan JS, Wrensch MR, et al. Genome-wide association study of glioma subtypes identifies specific differences in genetic susceptibility to glioblastoma and non-glioblastoma tumors. Nat Genet. 2017;49(5):789-794.
- Claus EB, Cornish AJ, Broderick P, et al. Genome-wide association analysis identifies a meningioma risk locus at 11p15.5. Neuro Oncol. 2018;20(11):1485-1493.
- Rice T, Lachance DH, Molinaro AM, et al. Understanding inherited genetic risk of adult glioma – a review. Neurooncol Pract. 2016;3(1):10-16.
- Bondy ML, Scheurer ME, Malmer B, et al. Brain tumor epidemiology: consensus from the Brain Tumor Epidemiology Consortium. Cancer. 2008;113(S7):1953-1968.
- Mathews JD, Forsythe AV, Brady Z, et al. Cancer risk in 680,000 people exposed to computed tomography scans in childhood or adolescence: data linkage study of 11 million Australians. BMJ. 2013;346:f2360.
- Pearce MS, Salotti JA, Little MP, et al. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: a retrospective cohort study. Lancet. 2012;380(9840):499-505.
- Rajaraman P, Doody MM, Yu CL, et al. Cancer Risks in US Radiologic Technologists Working With Fluoroscopically Guided Interventional Procedures, 1994-2008. American Journal of Roentgenology. 2016;206(5):1101-1109.
- https://www.iarc.who.int/wp-content/uploads/2018/07/pr208_E.pdf
- Navas-Acién A, Pollán M, Gustavsson P, Plato N. Occupation, exposure to chemicals and risk of gliomas and meningiomas in Sweden. Am J Ind Med. 2002;42(3):214-227.
- Claus EB, Black PM, Bondy ML, et al. Exogenous hormone use and meningioma risk: what do we tell our patients? Cancer. 2007;110(3):471-476.
Begrænsningerne i kræftregistre
Kræftregistre er udviklet til at indsamle data om maligne tumorer og indsamler ofte ikke data om ikke-ondartede (undertiden kaldet godartede) tumorer. Da omkring halvdelen af de primære hjernetumorer er ikke-ondartede, bliver disse tumorer ikke overvågey af folkesundhedsovervågningssystemer (f.eks. i Canada).
USA har et Central Brain Tumor Registry (CBTRUS): “en ressource til indsamling og formidling af aktuelle epidemiologiske data om alle primære hjernetumorer, godartede og ondartede, med det formål nøjagtigt at beskrive deres forekomst og overlevelsesmønstre, evaluere diagnose og behandling, lette ætiologiske undersøgelser, etablere bevidsthed om sygdommen og i sidste ende til forebyggelse af alle hjernetumorer.” CBTRUS fremsætter imidlertid ingen erklæringer eller garantier og giver ingen andre forsikringer eller garantier, udtrykkelige eller underforståede, med hensyn til nøjagtigheden eller fuldstændigheden af de præsenterede data.
Der er en god grund til ansvarsfraskrivelsen på CBTRUS-hjemmesiden. Tumorregistre er kun nyttige til overvågning af sygdomsforekomst i det omfang, at alle procedurer er godt implementeret. Registre er meget afhængige af rapporteringsstederne (f.eks. hospitaler) for at kunne udføre et nøjagtigt og komplet arbejde med at rapportere tumorer til registreringsdatabasen.
Data fra registreringsdatabase lider typisk af forskellige problemer:
“Brugere skal være opmærksomme på forskellige problemer, der påvirker indsamling og fortolkning af kræftregisterdata, såsom flere kræftdiagnoser, duplikatrapporter, rapporteringsforsinkelser, fejlklassificering af race / etnicitet og faldgruber i estimater af kræftforekomster.” (Izqierdo, JN, Schoenbach, VJ. Potentialet og begrænsningerne ved data fra befolkningsbaserede statslige kræftregistre. Am J Folkesundhed. 2000;90:695-698.
URL-adresse: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1446235/)
Forsinkelser i rapportering og sen konstatering er en realitet, og et kendt problem, der påvirker registrets fuldstændighed, og som følge heraf forekommer der undervurderinger, især for de seneste år. 22 CBTRUS erkender også, at problemet kan være endnu mere tilbøjelige til at opstå ved indberetning af ikke -maligne hjerne- og CNS-tumorer, hvor rapportering ofte kommer fra ikke-hospitalbaserede kilder og påbudt indsamling er relativt nylig (2004). Ostrom et al. (2014).
URL-adresse:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4193675/).
For en diskussion af de faktorer, der underminerer datakvaliteten og fuldstændigheden af kræftregisterdækning af diagnosticerede tumorer, se Bray et al (2015), Coebergh et al (2015) og Siesling et al (2015).
Manglerne ved kræftregistre er ikke kun hypotetiske. For eksempel rapporterede Hardell og Carlberg (2015), at hjernekræftfrekvensen har været stigende i Sverige baseret på det svenske nationale indlæggelsesregister, men ikke ifølge det svenske kræftregister. Baseret på deres resultater “postulerer de, at en stor del af hjernetumorer af ukendt type aldrig rapporteres til Cancerregistret … Vi konkluderer, at det svenske kræftregister ikke er pålideligt …”