
Det komplekse forhold mellem radiofrekvent eksponering og kræftceller
Elektromagnetiske felter (EMF’er) interagerer med biologiske systemer, som indeholder ladede ioner og polariserede molekyler, der påvirker cellemembraner, transmembranpotentialer og cellecyklusser.
Ved høje koncentrationer er frie radikaler og radikal-afledte ikke-radikale reaktive arter farlige for levende organismer og kan beskadige alle væsentlige cellulære bestanddele.
Formålet med undersøgelse af Hakki Gurhan et al. er todelt: For det første at undersøge, hvordan RF-eksponering modulerer oxidativt stress i kræftceller, hvilket potentielt bidrager til onkogenese; og for det andet at undersøge, om specifikke frekvenser kan sensibilisere kræftceller over for terapeutiske interventioner.
Undersøgelsen understreger nødvendigheden af at revidere de nuværende eksponeringsstandarder for RF-felter i betragtning af de observerede biologiske effekter på niveauer langt under de eksisterende sikkerhedsretningslinjer.
Oxidativ stress og kræft
Oxidativ stress er en kritisk faktor i kræftprogression, primært gennem generering af frie radikaler, som ofte omtales som reactive oxygen species (ROS), der fører til DNA-skader, lipidperoxidation og proteinmodifikationer. Moduleringen af ROS- og antioxidantenzymaktiviteter er vigtig for kræftbehandling og har endvidere implikationer for aldersrelaterede sygdomme, hvor oxidativt stress er en central faktor i cellulær degeneration.
Resultaterne tyder på, at RF-felter kan tjene som et terapeutisk værktøj til selektivt at modulere oxidativt stress og mitokondriefunktionen i kræftceller, hvor antioxidanter spiller en nøglerolle i at afbøde potentielle bivirkninger. Men i kræftceller er balancen mellem ROS-generering og antioxidantresponser dog særligt finjusteret. Små stigninger i mitokondriel ROS kan fremme tumorgenese, mens overdreven ROS kan føre til celledød, hvilket understreger den sarte ligevægt, som disse celler skal opretholde.
Med henblik på folkesundheden understreger undersøgelsen nødvendigheden af at revidere de nuværende eksponeringsstandarder for RF-felter i betragtning af de observerede biologiske effekter, den frekvensspecifikke modulering af oxidative stressmarkører og antioxidantresponser, på niveauer langt under de eksisterende sikkerhedsretningslinjer.
Herunder får du et længere uddrag af forskningsartiklen (understregningerne er tilføjet):
Frekvensafhængige antioxidantresponser i HT-1080 humane fibrosarkomceller udsat for svage radiofrekvensfelter
Frequency-Dependent Antioxidant Responses in HT-1080 Human Fibrosarcoma Cells Exposed to Weak Radio Frequency Fields; Hakki Gurhan og Frank Barnes, Department of Electrical, Computer and Energy Engineering, University of Colorado Boulder, USA. Udgivet 15. oktober 2024 på MDPI.
https://doi.org/10.3390/antiox13101237
Abstrakt
Undersøgelsen udforsker det komplekse forhold mellem radiofrekvent eksponering (RF) og kræftceller med fokus på HT-1080 human fibrosarkomcellelinje (Fibrosarkom, Bindevæv, som holder knogler, muskler og organer på plads). Vi undersøgte moduleringen af reaktive iltarter (ROS) og vigtige antioxidantenzymer, herunder superoxiddismutase (SOD), peroxidase og glutathion (GSH), samt mitokondrielle superoxidniveauer og cellelevedygtighed. Eksponering for RF-felter i 2-5 MHz-området ved meget svage intensiteter (20 nT) over 4 dage resulterede i tydelige, frekvensspecifikke cellulære effekter. Signifikante stigninger i SOD- og GSH-niveauer blev observeret ved 4 og 4,5 MHz, ledsaget af reducerede mitokondrielle superoxidniveauer og forbedret cellelevedygtighed, hvilket tyder på forbedret mitokondriefunktion. I modsætning hertil inducerede lavere frekvenser som 2,5 MHz oxidativt stress, hvilket fremgår af GSH-udtømning og øgede mitokondrielle superoxidniveauer. Resultaterne viser, at kræftceller udviser frekvensspecifik følsomhed over for RF-felter selv ved intensiteter, der er betydeligt under de nuværende sikkerhedsstandarder, hvilket understreger behovet for at revurdere eksponeringsgrænserne. Derudover giver vores analyse af den radikale parmekanisme (RPM) dybere indsigt i RF-inducerede cellulære responser. Moduleringen af ROS- og antioxidantenzymaktiviteter er vigtig for kræftbehandling og har bredere implikationer for aldersrelaterede sygdomme, hvor oxidativt stress er en central faktor i cellulær degeneration. Resultaterne tyder på, at RF-felter kan tjene som et terapeutisk værktøj til selektivt at modulere oxidativt stress og mitokondriefunktionen i kræftceller, hvor antioxidanter spiller en nøglerolle i at afbøde potentielle bivirkninger.
1. Indledning
Kræft er fortsat en af de førende årsager til dødelighed på verdensplan, hvilket nødvendiggør en løbende udforskning af avancerede terapeutiske og forebyggende strategier. Et voksende interesseområde er effekten af radiofrekvent eksponering (RF), som er blevet allestedsnærværende i det moderne liv [1,2]. Siden 1920’erne er RF-eksponeringen steget markant på grund af den udbredte brug af forskellige kommunikations- og sikkerhedsenheder. Disse elektromagnetiske felter (EMF’er) interagerer med biologiske systemer, som indeholder ladede ioner og polariserede molekyler, der påvirker cellemembraner, transmembranpotentialer og cellecyklusser [3]. Nylige undersøgelser inden for kvantebiologi har udvidet denne forståelse og tyder på, at svage magnetfelter, herunder dem, der produceres af RF-eksponering, kan modulere biologiske processer på kvanteniveau [4,5]. Denne modulation sker især gennem mekanismer, der involverer spintilstande og radikal parrekombination. [6,7]. Sådanne kvanteeffekter kan spille en væsentlig rolle i, hvordan RF-felter påvirker cellulære processer, herunder generering af oxidativ stress og reaktive iltarter (ROS) [8].
Ved høje koncentrationer er frie radikaler og radikal-afledte ikke-radikale reaktive arter farlige for levende organismer og kan beskadige alle væsentlige cellulære bestanddele [9]. Ved lavere koncentrationer kan nitrogenoxid (NO), superoxidanion (O2•−), og relateret ROS have vigtige roller som regulatoriske mediatorer i pattedyrs cellesignalprocesser. For eksempel intracellulære koncentrationer af hydrogenperoxid (H2O2) i ikke-stressede pattedyrsceller typisk i intervallet 1-100 nM, mens niveauerne kan stige til flere mikromolare under oxidative stressforhold. På samme måde holdes O2•− niveauer i mitokondrier generelt lave gennem effektiv dismutation af superoxiddismutase (SOD) for at producere H2O2. Den fysiologiske koncentration af NO varierer fra 20 nM til 1 μM, afhængigt af celletypen og omfanget af stimulering af nitrogenoxidsyntase (NOS). Disse moderate niveauer er afgørende for deres funktion som signalmolekyler, der muliggør regulering af vaskulær tonus, immunrespons og apoptose, blandt andre processer [10,11]. Elektrontransportkæden (ETC) i mitokondrier er et kritisk sted for ROS-produktion, primært gennem aktiviteten af forskellige redox-aktive molekyler, der udviser hyperfine frekvenser [12].
Barnes og Freeman understregede, at biologiske systemer reagerer på svage EMF’er ved energiniveauer, der ligger langt under de nuværende sikkerhedsretningslinjer, hvilket indikerer et behov for reviderede eksponeringsstandarder [13]. For eksempel har magnetfelter omkring 35 μT, svarende til det geomagnetiske felt, vist sig at påvirke menneskelig hjernebølgeaktivitet, hvilket viser hjernens følsomhed selv ved lave intensiteter [14]. Statiske magnetfelter (SMF’er) på 300 og 400 μT er blevet observeret for at accelerere HT-1080 fibrosarkomkræftcellevækst og ændre ROS-koncentrationer, mens 0,5 μT og 600 μT-felter hæmmer vækst [15]. Usselman et al. fandt, at RF-magnetfelter på 20 μT rms ved 1,4 MHz kombineret med et 50 μT statisk felt reducerede O2•− niveauer med 36 % og H2O2 med 21 % i den vinkelrette orientering, med forskellige effekter i den parallelle orientering [16]. Disse resultater understreger behovet for opdaterede retningslinjer for EMF-eksponering.
Den radikale parmekanisme (RPM) forklarer, hvordan svage magnetfelter kan påvirke kemiske reaktioner i biologiske systemer. RPM involverer molekyle par eller atomer med uparrede elektroner, som kan interagere med hinanden samt magnetiske felter, hvilket påvirker deres rekombinationshastigheder og veje [17,18]. Ifølge Grissom kan magnetfelter modulere hastigheden af radikalparrekombination i biologiske systemer gennem flere mekanismer, herunder hyperfininduceret krydsning mellem systemer og spin-kredsløbskobling [19]. Disse mekanismer kan ændre produktions- og rekombinationshastighederne for radikalpar betydeligt og dermed påvirke ROS-generering og den oxidative stressrespons i celler.
Sheppard et al. bemærkede, at vibrationstilstande under det fjern-infrarøde område dæmpes af vand, hvilket fremhæver RPM og dielektrisk opvarmning som nøgleinteraktioner for RF-felter ved almindelige eksponeringsniveauer [20]. Timmel og Hore viste, at oscillerende magnetfelter, når de matcher hyperfine opdelingsfrekvenser, kan ændre radikale parreaktionsudbytter med op til 25 %, hvilket understreger singlet-triplet-interkonvertering [21]. Austvold et al. demonstrerede, hvordan magnetfelter modulerer ROS-fordeling i flavoenzymer, hvilket hjælper med at forklare, hvordan RF-felter kan påvirke ROS-produktion og antioxidantenzymaktivitet i kræftceller [22]. Zadeh-Haghighi og Simon et al. fremhævede lignende resultater og viste, at svage magnetfelter kunne modulere radikale parreaktioner, hvilket potentielt kan påvirke ROS-dynamikken i kræftceller [23].
1.1. Oxidativ stress og kræft
Oxidativ stress er en kritisk faktor i kræftprogression, primært gennem generering af ROS, der fører til DNA-skader, lipidperoxidation og proteinmodifikationer [24]. Disse oxidative modifikationer kan fremme tumorinitiering, progression samt resistens over for terapi. Disse processer er ikke kun afgørende for kræft, men er også vigtige bidragydere til aldring og andre sygdomme [25]. Mitokondrierne, som storproducenter af ROS, spiller en central rolle i disse processer [26]. H2O2, en kritisk ROS, er særlig vigtig i kræftceller, hvor dens regulerede produktion og afgiftning er afgørende for tumorcelleoverlevelse og progression [27]. ROS, såsom superoxid og H2O2, genereres primært i mitokondrierne under cellulær respiration. Mens kompleks I og III i ETC er de primære kilder, bidrager kompleks II også under visse forhold, hvor elektronlækage fører til ROS-dannelse under ATP-produktion [28]. Når ROS produceres i overskud, overvælder de de cellulære antioxidantforsvarsmekanismer, hvilket fører til oxidativt stress [29]. Hver ROS-type har forskellige cellulære mål og effekter. For eksempel spiller H2O2 en central rolle i cellesignalering ved selektivt at modificere proteinfunktioner. Forkert regulering af H2O2 kan føre til dannelse af meget reaktive hydroxylradikaler (•OH), hvilket forårsager en omfattende skade på cellulære komponenter, såsom DNA, proteiner og lipider [30].
Sies et al. understregede vigtigheden af at skelne mellem oxidativ eustress, som involverer fysiologiske afvigelser fra steady-state redox-indstillingspunktet, der hjælper med adaptiv signalering, og oxidativ nød, som skyldes overdreven oxidativ udfordring og forårsager biomolekylær skade og forstyrrede signalveje [31]. I kræftceller forstyrres balancen mellem ROS-produktion og antioxidantforsvar ofte [32]. Denne ubalance kan forbedre kræftcellers overlevelse, proliferation og metastase ved at aktivere forskellige signalveje [33].
1.2. Antioxidanter forsvarsmekanismer
Celler har et komplekst antioxidantforsvarssystem for at afbøde oxidativ skade. Vigtige antioxidantenzymer omfatter SOD, som omdanner superoxid til H2O2; katalase (CAT), som nedbryder H2O2 i vand og ilt; og glutathionperoxidase (GPx), som reducerer H2O2 og lipidperoxider ved hjælp af glutathion (GSH). Disse enzymer er afgørende ikke kun for at forhindre oxidativ skade, men også for at regulere ROS-niveauer involveret i signalveje [34]. Som vist i figur 1 er aktiviteterne af disse antioxidantenzymer indbyrdes forbundne og afgørende for at afbøde oxidativt stress.
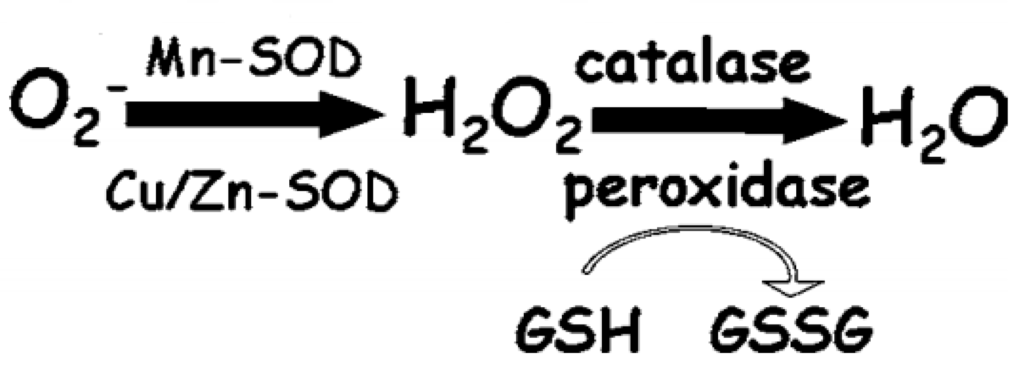
SOD’er, en gruppe af kritiske antioxidantenzymer, katalyserer dismutationen af superoxidradikaler til H2O2. Denne reaktion udgør den første forsvarslinje mod ROS. Det producerede H2O2 kan reagere med nærliggende reducerede thioler eller overgangsmetaller, hvilket forværrer oxidativt stress, hvis det ikke afgiftes tilstrækkeligt af efterfølgende enzymatisk virkning. Omlægningen af H2O2 til vand er afgørende for at forhindre oxidativ skade, faciliteret af enzymer som katalase og GPx, som bruger GSH til at reducere H2O2. Reduktionen af GSH til GSSG (glutathiondisulfid) er en vigtig markør for oxidativt stress; et højt GSH/GSSG-forhold er et typisk tegn på en reduceret, ikke-stresset tilstand, mens et lavt forhold peger på oxidativ ubalance.
1.3. Radikal parmekanisme
Radikale par dannes gennem normale metaboliske processer, såsom mitokondriel respiration. Disse par består af molekyler eller atomer med uparrede elektroner, hvis interaktioner kan påvirkes af magnetfelter. Ifølge Woodward et al. [36] forklarer RPM, hvordan magnetfelter ændrer det kemiske resultat ved at påvirke spintilstandene af radikale par. Brocklehurst [37] beskriver, hvordan overgangen mellem singlet- og triplettilstande af radikale par moduleres af Zeeman og hyperfine interaktioner, hvilket påvirker reaktionskinetik og produktdannelse.
Hyperfine interaktioner forekommer mellem uparrede elektroner og nukleare spin af naboatomer, hvilket modulerer reaktiviteten af fotoinducerede radikaler som dem, der involverer flavinadenindinukleotid (FAD) og tryptofan. Zeeman-interaktioner, som er forårsaget af eksterne magnetfelter, påvirker singlet-triplet-overgange og effektiviteten af ROS-produktionen, hvilket gør RPM til en potentiel forklaring på magnetfelteffekter på biologiske systemer. Barnes og Greenebaum [38] foreslår, at svage magnetfelter, som dem, der blev brugt i vores undersøgelse, kan ændre radikale parkombinationshastigheder og dermed ændre ROS-koncentrationer og efterfølgende oxidative stressresponser.
I vores undersøgelse giver RPM en plausibel forklaring på, hvordan RF-felter påvirker oxidativt stress og antioxidantenzymaktiviteter. RF-eksponering ved specifikke frekvenser kan interagere med hyperfine koblinger inden for radikale par, hvilket påvirker ROS-produktionen, som forklaret i forbindelse med magnetfelteffekter på biologiske systemer [39]. Formålet med denne undersøgelse er todelt: for det første at undersøge, hvordan RF-eksponering modulerer oxidativt stress i kræftceller, hvilket potentielt bidrager til onkogenese; og for det andet at undersøge, om specifikke frekvenser kan sensibilisere kræftceller over for terapeutiske interventioner. Identifikation af den optimale frekvens, der maksimerer eller minimerer biologiske virkninger, såsom ROS-generering eller antioxidantaktivitet, kan være afgørende for at udvikle nye terapeutiske strategier. Yderligere undersøgelser vil også være nødvendige for at vurdere effekterne af RF på normale celler for at evaluere potentielle off-target effekter.
1.4. Hyperfine resonanser indflydelse på elektrontransportkæden (ETC)
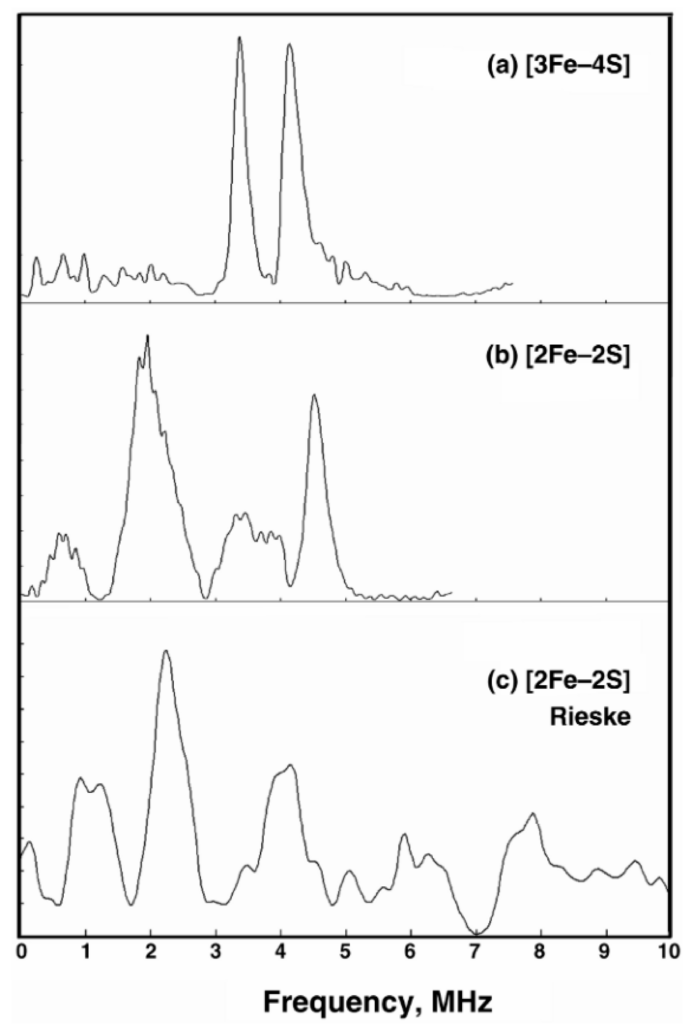
Forbedring af mitokondriefunktion og antioxidantforsvar giver potentiale til kræftforebyggelse og behandling af aldersrelaterede sygdomme [40]. ETC i mitokondrier er et vigtigt sted for ROS-produktion, primært på grund af aktiviteten af redox-aktive molekyler som FAD, ubiquinon (CoQ10) og jern-svovl-klynger. Disse molekyler danner ofte radikale par, der er følsomme over for eksterne magnetfelter på grund af hyperfine interaktioner. Maly et al. [41] fremhæver den afgørende rolle af Fe-S-klynger, især N2 klynger i mitokondriekompleks I, i modulering af elektronoverførsel og ROS-produktion.
Hyperfine interaktioner i jern-svovl-klynger, især i kompleks I, spiller en væsentlig rolle i elektronoverførselsprocesser. Disse interaktioner modulerer singlet-triplet-konverteringshastighederne for radikale par og påvirker derved effektiviteten af ROS-produktionen. Ubiquinon, en essentiel elektronbærer, danner semiquinonradikaler under sin redoxcyklus. De hyperfine interaktioner i disse radikaler kan påvirke deres rekombinationshastigheder, påvirke den samlede elektronstrøm gennem ETC og bidrage til oxidativt stress. Derudover er Fe-S-klyngerne i kompleks I, II og III på grund af deres hyperfine interaktioner modtagelige for ændringer i redoxtilstande, hvilket kan føre til øget ROS-produktion under visse RF-feltforhold. Som vist i figur 2 indikerer tilstedeværelsen af fremtrædende toppe i ESEEM-spektrene betydelige hyperfine koblinger, som kan påvirke effektiviteten af elektronoverførsel og ROS-produktion
1.5. Radiofrekvent (RF) felteffekt på antioxidanter
De indbyrdes forbundne aktiviteter af SOD og GPx illustrerer et koordineret forsvar mod oxidativt stress og spiller en central rolle i opretholdelsen af redox-homeostase [42]. SOD afbøder de oprindelige superoxidradikaler og omdanner dem til H2O2, som GPx derefter reducerer til vand. Enhver ubalance i dette system kan føre til ophobning af ROS, efterfølgende oxidativt stress og forkert signalering gennem forskellige cellulære veje [43]. Ikke-ioniserende stråling, ligesom RF-felter, ændrer spintilstandene for radikale par, hvilket påvirker ROS-produktionen gennem spin-tilstandsmodulation [44]. For eksempel, hvis RF-eksponering øger ROS-produktionen ud over hvad SOD’s og GPx’s kapacitet kan håndtere, kan dette resultere i øget oxidativt stress, som indikeret af ændringer i GSH/GSSG-forholdet. Denne forstyrrelse i redoxbalancen har været impliceret i udviklingen af forskellige sygdomme, herunder kræft. Desuden kan indflydelsen af RF-felter på radikale par, især dem, der dannes under metaboliske processer, ændre ROS-produktion og antioxidantenzymaktiviteter.
For at udforske indflydelsen af RF-eksponering på disse vigtige antioxidantforsvar er det nødvendigt med en detaljeret undersøgelse af de mekanismer, hvormed RF-felter påvirker cellulær oxidativ stress. En plausibel mekanisme involverer anvendelsen af RF-felter ved frekvenser nær de hyperfine resonanser af vigtige ETC-molekyler såsom FAD, CoQ10 og jern-svovl-klynger. Disse hyperfine interaktioner kan ændre spintilstande og rekombinationshastigheder af radikale par dannet under metaboliske processer. Moduleringen af disse spintilstande kan føre til ændringer i mitokondriefunktionen og det samlede oxidative stressniveau.
Valget af 2-5 MHz-området er baseret på kendte hyperfine resonanser af jern-svovl-klynger og andre nøglekomponenter i ETC i mitokondrier. Undersøgelser har vist, at visse jern-svovlklynger i mitokondriekomplekser, især kompleks I, udviser hyperfine overgange inden for dette frekvensområde. Ved at målrette disse frekvenser er målet at modulere elektronoverførselsprocesser i ETC, hvilket potentielt kan påvirke ROS-produktion og antioxidantenzymaktivitet. Hvis disse ændringer resulterer i øgede ROS-niveauer, kan antioxidantenzymerne SOD og GPx blive overvældet og undlade at opretholde redox-homeostase. Det vil derfor manifestere sig som et ændret GSH/GSSG-forhold, hvilket indikerer øget oxidativt stress. Forståelsen af disse interaktioner giver afgørende indsigt i, hvordan RF-felter modulerer oxidativt stress og fremhæver potentialet for antioxidanter til at afbøde disse virkninger.
Tidligere forskning [45] har undersøgt effekterne af RF-eksponering på oxidativt stress og ROS-niveauer i forskellige celletyper. Nogle undersøgelser har rapporteret øget ROS-produktion og oxidativ skade i RF-eksponerede celler, mens andre ikke har fundet nogen signifikante effekter. Denne variation i resultaterne understreger kompleksiteten af RF-effekter, muligvis på grund af forskelle i eksperimentelle forhold, celletyper og eksponeringsparametre. Denne uoverensstemmelse understreger behovet for yderligere forskning for at afklare virkningen af RF-eksponering på oxidativt stress og kræftprogression.
4. Diskussion
I biologiske systemer kan hyperfin resonans påvirke enzymaktiviteten, hvis enzymet indeholder paramagnetiske centre såsom metalioner. SOD, især de former, der indeholder metalioner (Cu/Zn-SOD og Mn-SOD), kan blive påvirket af hyperfine interaktioner, fordi disse metalcentre er paramagnetiske. Hyperfine interaktioner kan modulere SOD-aktivitet, hvilket potentielt kan øge produktionen af superoxidradikaler eller ændre enzymets evne til at omdanne superoxidradikaler til H2O2.
De differentielle responser af GSH og SOD ved 2 MHz og 2.5 MHz kan tilskrives hyperfine resonanseffekter på SOD. Ved 2.5 MHz kan den øgede SOD-aktivitet skyldes opregulering af SOD-ekspression som reaktion på RF-behandlingen, hvilket fører til betydelig oxidativ stressstyring og GSH-udtømning. Ved 2 MHz er effekten mindre udtalt, hvilket resulterer i betydelig GSH-udtømning uden en tilsvarende stigning i SOD-aktiviteten. Dette indikerer en frekvensspecifik modulation af oxidative stressmarkører. Betydelige stigninger i GSH-niveauer ved 3 MHz og 4 MHz tyder på forbedret mitokondriel effektivitet og antioxidantresponser.Vores tidligere data [56] viste signifikant cellevækst omkring 4 MHz, hvilket stemmer overens med de nuværende resultater af øgede SOD- og GSH-niveauer og faldende H2O2 niveauer med denne frekvens. Dette tyder på en potentiel forbindelse til hyperfine resonanseffekter på mitokondrielle metalloproteiner, hvilket fører til øget mitokondriel proliferation. Det understøtter hypotesen om robust antioxidantrespons og effektiv håndtering af ROS ved specifikke frekvenser. I kræftceller er balancen mellem ROS-generering og antioxidantresponser særligt finjusteret. Små stigninger i mitokondriel ROS kan fremme tumorgenese, mens overdreven ROS kan føre til celledød, hvilket understreger den sarte ligevægt, som disse celler skal opretholde [57,58]. Phaniendra et al. [59] understreger, hvordan akkumulering af ROS over tid fremskynder aldring og øger modtageligheden for forskellige sygdomme ved at inducere skader på lipider, proteiner og DNA.
Resultaterne fra Kıvrak et al. giver væsentlig dokumentation for, at EMF-eksponering forstyrrer antioxidantforsvarssystemet, hvilket fører til øget oxidativt stress [60]. Tilsvarende foreslår Snezhkina et al. [61] at ROS-generering i normale og ondartede celler primært er drevet af mitokondriel elektronlækage. Vores undersøgelse viser, at RF-felter kan modulere mitokondriel ROS gennem hyperfine interaktioner, der påvirker vigtige paramagnetiske centre som jern-svovlklynger, hvilket ændrer elektronoverførselseffektiviteten. De frekvensspecifikke ændringer i SOD og GSH understøtter yderligere disse interaktioners rolle i modulering af ROS-produktion og antioxidantenzymaktiviteter. Desuden påviste Zhang et al., at afskærmning af det geomagnetiske felt (HMF) signifikant reducerede H2O2 produktion i humane neuroblastomceller og hæmmede aktiviteten af CuZn-SOD [62]. Det tyder på, at miljømagnetfelter, herunder dem, der ændres af RF-eksponering, kan påvirke ROS-produktionen og aktiviteten af vigtige antioxidantenzymer betydeligt.
Superoxidmålinger på tværs af varierende frekvenser afslørede tydelige mønstre i mitokondriel ROS-produktion. Ved både 4 MHz og 4,5 MHz steg SOD-aktiviteten betydeligt, mens mitokondrie superoxidniveauerne faldt. Det tyder på, at RF-eksponering ved disse frekvenser forbedrer antioxidantforsvaret ved at øge SOD-aktiviteten og derved reducere mitokondrielle superoxidniveauer. Disse resultater indikerer, at 4 og 4,5 MHz kan inducere en resonanseffekt, der optimerer balancen mellem ROS-produktion og antioxidantrespons, hvilket understøtter forbedret mitokondriefunktion. Vurderinger af ellelevedygtighed bekræfter yderligere forholdet mellem mitokondriefunktion og RF-eksponering. Den øgede cellelevedygtighed observeret ved 4 MHz svarer til forbedrede antioxidantresponser og reducerede oxidative stressmarkører, hvilket understreger den rolle, som specifikke frekvenser spiller i at fremme kræftcelleoverlevelse. Omvendt afspejler reduceret levedygtighed og GSH-udtømning ved 3.5 MHz øget oxidativt stress og potentiel celleskade. Disse resultater understreger den nuancerede indvirkning af RF-frekvens på ROS-dynamik, celleoverlevelse og mitokondriefunktion.
Biologiske reaktioner på EMF’er afhænger af parametre som frekvens, intensitet, modulation og eksponeringsvarighed. Franco-Obregón understregede vigtigheden af eksperimentelle betingelser, herunder omgivende magnetfelter, temperatur og celletæthed, som i væsentlig grad kan påvirke reproducerbarheden og fortolkningen af resultater i EMF-undersøgelser [63]. Disse faktorer skal kontrolleres omhyggeligt for at sikre ensartede og pålidelige resultater. På samme måde fremhævede Portelli et al. [64], at baggrundsmagnetfeltvariabilitet i biologiske inkubatorer kan være en forvirrende faktor, der påvirker eksperimentel reproducerbarhed. Ved at adressere disse variabler kan de observerede effekter i denne undersøgelse sandsynligvis tilskrives de anvendte EMF’er snarere end miljøstøj.
Vores resultater stemmer overens med beskrivelser af kvantebiologiske processer, hvor svage magnetfelter påvirker rekombinationshastigheden af radikale par. RPM forklarer, hvordan svage magnetfelter kan påvirke kemiske reaktioner i biologiske systemer ved at påvirke rekombinationshastigheden af radikale par [65]. Ifølge Challis er energien af en foton i et RF-felt betydeligt lavere end den, der kræves for at ionisere et typisk molekyle, hvilket gør det usandsynligt, at RF-felter forårsager direkte ionisering eller excitation [66]. RF-felter kan dog påvirke radikale par, som er mellemprodukter i mange kemiske reaktioner og dannes med enten antiparallelle eller parallelle spin. Anvendelsen af RF-stråling ved den hyperfine spaltningsfrekvens kan øge den tid, disse par tilbringer i triplettilstanden, og dermed øge sandsynligheden for deres dissociation til frie radikaler. Som vist af Ritz et al. kan selv svage oscillerende magnetfelter inden for 0,1-10 MHz-området ved styrker så lave som 85 nT have betydelige biologiske effekter, hvilket understøtter ideen om, at radikale par er følsomme over for sådanne felter [67].
Rodgers og Hore beskriver RPM som involverende par af forbigående radikaler, hvis kemiske skæbner styres af svage magnetiske interaktioner via deres spin-tilstande [68]. Disse radikaler skabes samtidigt og kan eksistere i singlet- eller triplettilstande, som konverterer hinanden under påvirkning af magnetfelter. Singlet-triplet-interkonverteringen moduleres af hyperfine interaktioner og Zeeman-effekten, som kan ændre reaktionsudbyttet afhængigt af orienteringen og styrken af det eksterne magnetfelt. Timmel et al. viste, at selv svage magnetfelter kan ændre produktudbyttet betydeligt, hvor produktionen af frie radikaler øges og rekombinationen undertrykkes med 10-40 % afhængigt af resonansbetingelserne. Eventuelle resonanseffekter fra oscillerende magnetfelter forventes at forekomme ved frekvenser mellem 1 og 100 MHz, hvilket matcher energiniveauopdelingerne produceret af hyperfine interaktioner i det radikale par [69]. De beregnede Zeeman-energier fremhæver potentialet for, at RF-felter kan påvirke radikale par ved at inducere overgange ved specifikke frekvenser. For eksempel falder overgangsfrekvenserne for elektronspintilstande i Jordens magnetfelt (~45 μT) typisk mellem 1 og 10 MHz [70]. Disse overgange kan ændre rekombinationshastigheden af radikale par, hvilket påvirker produktionen af ROS og aktiviteterne af antioxidantenzymer.
Under de påførte magnetfeltintensiteter på 20 nT målte vi de resulterende elektriske felter i mediet og afslørede værdier på 1,128 V/m. Vores undersøgelse understreger nødvendigheden af at revidere de nuværende eksponeringsstandarder for RF-felter under hensyntagen til de observerede biologiske effekter på niveauer under eksisterende sikkerhedsretningslinjer. Den frekvensspecifikke modulering af oxidative stressmarkører og antioxidantresponser understreger behovet for opdaterede retningslinjer for at sikre folkesundheden. I øjeblikket fastsætter Den Internationale Kommission for Beskyttelse mod Ikke-Ioniserende Stråling (ICNIRP) referenceniveauet for erhvervsmæssig eksponering for RF-felter i 2-5 MHz-regionen til 61 V/m. I betragtning af vores resultater kan disse standarder kræve revurdering for bedre at beskytte mod potentielle biologiske effekter.
Kvantebiologiske principper såsom kohærens, sammenfiltring og resonans er grundlæggende for at forstå disse effekter. Kohærens refererer til egenskaben ved elektronspin, der opretholder en korreleret tilstand over tid, hvilket er afgørende for, at magnetfeltet har en betydelig effekt. Sammenfiltring involverer den indbyrdes forbundne tilstand af elektronspin, hvilket betyder, at tilstanden af en elektron øjeblikkeligt kan påvirke tilstanden af en anden. Resonans opstår, når frekvensen af det påførte magnetfelt matcher den naturlige frekvens af det radikale parsystem, hvilket fører til maksimal følsomhed og effekt. Disse principper er nøglen til at forklare, hvordan selv meget svage RF-felter kan producere betydelige biologiske effekter. I forbindelse med vores undersøgelse kan anvendelse af RF-felter ved specifikke frekvenser påvirke spintilstandene hos radikale par dannet under metaboliske processer i kræftceller. Nunn et al. beskriver, hvordan kvanteeffekter, såsom tunneling og kohærens, er afgørende for mitokondriefunktion, især i elektrontransport, hvilket er afgørende for ATP-produktion [71]. Forstyrrelser i disse processer, især med aldring, bidrager til mitokondriel dysfunktion og oxidativt stress. Hormetisk stress, såsom det, der induceres af svage RF-felter, kan forbedre mitokondriel kvanteeffektivitet og derved forbedre redoxbalancen og afbøde aldersrelateret mitokondriefald.
Selvom resultaterne giver værdifuld forståelse, skal nogle begrænsninger adresseres. Brugen af kun én kræftcellelinje (HT-1080 humant fibrosarkom) kan begrænse anvendeligheden af fundene til forskellige kræfttyper eller normale celler. Desuden, selvom flere tekniske replikater blev udført, blev der kun udført to uafhængige eksperimenter pr. parameter, hvilket potentielt påvirkede konklusionernes robusthed. Da dette er et in vitro-studie, fanger resultaterne muligvis ikke fuldt ud kompleksiteten af in vivo-miljøer. Fremtidig forskning bør involvere in vivo- eller in situ-undersøgelser for at validere disse resultater i mere biologisk relevante systemer, udforske en bredere vifte af cellelinjer, øge antallet af uafhængige eksperimenter og bekræfte de frekvensspecifikke virkninger på oxidativt stress. Desuden ville gentagelse af eksperimentet ved forskellige RF-amplituder hjælpe med at afklare, hvordan amplitudevariationer påvirker responshastighederne, især nær de observerede topændringer.
5. Konklusioner
Vores resultater afslører, at RF-eksponering ved specifikke frekvenser tydeligt modulerer aktiviteterne af vigtige antioxidantenzymer, såsom SOD og peroxidase, samt GSH-niveauer. Denne modulation understreger SOD’ernes dobbelte rolle i at kontrollere ROS-skader og regulere ROS-signalering, som beskrevet af Wang et al. [72]. Ved at afbalancere ROS-produktion og afgiftning er SOD’er afgørende for at opretholde cellulær homeostase og påvirke kræftcelleadfærd. Ved 2,5 MHz observerede vi signifikant oxidativt stress, indikeret af øget SOD-aktivitet og betydelig GSH-udtømning, hvilket tyder på, at hyperfine resonanseffekter ved denne frekvens kan forstærke superoxidradikalproduktionen, hvilket kræver en øget antioxidantrespons. I modsætning hertil førte eksponering ved 4 MHz til et robust antioxidantrespons, karakteriseret ved forhøjede SOD- og GSH-niveauer og nedsat H2O2. Dette faldt sammen med en stigning i cellelevedygtighed og nedsat mitokondriesuperoxid, hvilket indikerer forbedret mitokondriefunktion og en optimeret balance mellem ROS-produktion og antioxidantforsvar i kræftceller. Disse frekvensafhængige virkninger indebærer involvering af hyperfine resonansinteraktioner med mitokondrielle metalloproteiner, hvilket påvirker ROS-dynamikken betydeligt. Denne modulering af ROS og apoptose afspejler resultater, hvor RF-EMF-eksponering ændrede NADPH-homeostase og reducerede superoxidniveauer, hvilket bidrog til celleoverlevelse [73]. Antioxidanters potentiale til at afbøde RF-induceret oxidativt stress understreger behovet for yderligere forskning i antioxidantterapier.
Ved en anvendt RF-feltintensitet på 20 nT stemmer vores konklusioner overens med en bredere mængde dokumentation, der tyder på, at elektromagnetiske felter med lav intensitet udøver biologiske effekter gennem ikke-termiske mekanismer [74]. Desuden er der blevet rejst bekymring over effekten af RF-feltintensiteter under de nuværende sikkerhedsstandarder, især for følsomme befolkningsgrupper. Mens de nuværende eksponeringsstandarder primært er baseret på at undgå termiske effekter, tyder stigende dokumentation på, at ikke-termiske påvirkninger af RF-felter kan modulere oxidativt stress, ROS-produktion og andre cellulære processer [75]. Sådanne resultater henleder opmærksomheden på vigtigheden af at revurdere disse standarder.
Undersøgelse af det terapeutiske potentiale ved at kombinere RF-eksponering med antioxidant- eller pro-oxidantbehandlinger kan fremme vores forståelse af, hvordan RF-felter modulerer cellulære redoxtilstande. Disse resultater tyder på, at frekvensspecifik RF-eksponering selektivt kan påvirke kræftcelleoxidativt stress, hvilket potentielt forbedrer effektiviteten af konventionelle kræftbehandlinger. Visse RF-frekvenser kan enten øge eller mindske superoxid og andre oxidative stressmarkører og derved ændre balancen mellem ROS-produktion og antioxidantforsvar. Ved at øge kræftcellers modtagelighed for oxidativ skade kan RF-eksponering gøre dem mere sårbare over for behandlinger som kemoterapi eller stråling, som er afhængige af at inducere oxidativt stress. Disse mekanismer kan også være relevante for aldersrelaterede sygdomme, da oxidativt stress er en fælles faktor i både kræft og aldring, hvor mitokondriel dysfunktion og ROS-overproduktion bidrager til cellulær tilbagegang, som bemærket af Hajam et al. [76]. Desuden antyder begrebet mitohormesis, som beskrevet af Ristow [77], at kontrollerede ROS-niveauer kan udløse adaptive responser, der beskytter celler mod skader og derved understøtter lang levetid og sund aldring.



